Antecedentes:
Desde el inicio de la campaña de vacunación contra SARS-CoV-2 investigadores y expertos de
todo el mundo investigan la duración de la inmunidad generada por la infección y la generada a
través de las distintas plataformas vacunales en población general y en diferentes grupos de
personas. Así mismo evalúan la eventual necesidad de terceras dosis, refuerzos o incluso un
proceso de revacunación anual.
En toda campaña de vacunación debe tenerse en cuenta que algunas personas por su condición
de salud, medicación, edad, entre otras; pueden no desarrollar una respuesta inmune adecuada
después de una serie primaria y podrían necesitar una dosis adicional para lograr inmunidad
protectora.
La campaña de vacunación contra COVID-19 basada en tres vacunas: CoronaVac, Pfizer y
AstraZeneca, ha sido muy exitosa logrando altas coberturas vacunales que redundaron en una
caída marcada en casos, internaciones y fallecimientos.
Uruguay ha monitorizado la campaña de vacunación tanto con estudios de efectividad como con
estudios serológicos postvacunales en personal de salud y en población general.
De los datos primarios al 30 de junio surge que la efectividad del esquema primario de Pfizer de
78% para reducir la infección y 97,8% para reducir la internación en CTI y 96,2% para reducir la
mortalidad. Con CoronaVac la efectividad es de 59,9% para reducir la infección, 90,8% para
reducir la internación en CTI y 95 % para reducir la mortalidad.
¿Por qué se resuelve entonces administrar dosis de refuerzo al esquema primario?
Objetivos:
Se propone para nuestro país:
1. Optimizar la respuesta inmune en grupos especiales que presentan una respuesta
subóptima.
2. Aumentar la inmunidad global en la población, homogeneizando el uso de plataforma de
ARNm.
3. Fortalecer la inmunidad de la población ante la posibilidad de nuevas variantes de
preocupación, en especial la variante delta.
Vacunación de personas inmunodeprimidas:
Trabajos internacionales muestran que en grupos de trasplantados de órganos sólidos hepático,
renal, corazón, pulmón y páncreas a los 28 días luego de la segunda dosis, el 46% no tenían
anticuerpos detectables.
En los pacientes con cáncer, especialmente los hemato-oncológicos demostraron menor
respuesta de anticuerpos; en especial aquellos que recibieron inhibidores de células B y T
encargadas tanto del control de la infección como de la generación de anticuerpos y células de
memoria a largo plazo.
En datos nacionales preliminares del Programa Nacional de Trasplante Hepático se observó que
sólo el 40.3% de aquellos que completaron el esquema primario desarrolló anticuerpos a los 40 a
60 días de la segunda dosis. Si bien el menor desarrollo de anticuerpos se evidenció con las dos
plataformas; se observó menor respuesta con la vacuna CoronaVac.
De igual forma, la generación de anticuerpos en los pacientes con trasplante renal y
renopáncreas fue baja y los títulos de anticuerpos fueron menores que los obtenidos en la
población general.
En dos estudios de las revistas Annals of Internal Medicine y The New England Journal of
Medicine: se observó que con una tercera dosis el 33% de los pacientes trasplantados de órganos
sólidos seronegativos (que no desarrollaron anticuerpos), seroconvierten luego de la
administración de una vacuna de plataforma ARNm como Pfizer. En el segundo estudio, un 44%
de los seronegativos seroconvierten tras la tercera dosis. En pacientes en hemodiálisis, el 41% de
los seronegativos seroconvierten luego de la 3 dosis (Nephrology Dialysis Transplantation). En
todos los casos, el grupo de pacientes que había generado respuesta de anticuerpos con la
segunda dosis, tuvo un importante aumento en el título de anticuerpos en respuesta a la tercera
dosis.
Se consideran en este grupo de pacientes las siguientes patologías y tratamientos:
-Receptores de trasplante de órganos sólidos.
-Receptores de trasplante de precursores hematopoyéticos.
-Pacientes oncológicos y hematooncológicos en tratamiento quimioterápico o radioterapia.
-Pacientes en diálisis crónica.
-Enfermedades autoinmunes u otras que requieren tratamiento con inmunosupresores y/o
biológicos.
Todos estos pacientes han sido identificados por sus prestadores de salud y por el Fondo
Nacional de Recursos quienes proveyeron las listas al Ministerio de Salud Pública.
Esquema e intervalo de dosis
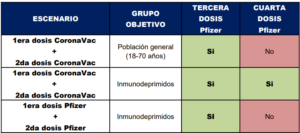
Si el esquema primario fue con CoronaVac se ofrece recibir dos dosis de vacuna ARNm (Pfizer)
con un intervalo de 28 días entre ambas. El intervalo entre la segunda y la tercera debe ser de al
menos un mes.
Si el esquema primario fue con vacuna ARNm (Pfizer) o AstraZeneca, se ofrece una dosis al
menos 1 mes luego de la última dosis administrada del esquema primario.
Las personas en diálisis crónica recibirán las dosis en su Centro de Diálisis, mientras que los
demás inmunodeprimidos deberán agendarse.
Se recomienda que las personas que conviven con el paciente inmunodeprimido estén
adecuadamente vacunadas.
Tercera dosis de vacuna contra COVID-19 en población general con esquema
primario con CoronaVac:
Se ofrece una tercer dosis de vacuna Pfizer a los pacientes que hayan recibido esquema primario
con CoronaVac, con el objetivo de reforzar la inmunidad. Esto es debido a la caída natural de los
anticuerpos neutralizantes y al riesgo de las variantes de preocupación del virus SARS-CoV-2 que
ya han ingresado a nuestro territorio.
1. Variantes de preocupación (VOC)
El virus SARS-CoV-2 va sufriendo mutaciones naturales, algunas de ellas se asocian a mayor
infectividad, transmisibilidad, y una menor capacidad de los anticuerpos generados por el
individuo para neutralizar al virus. En Uruguay, hasta el momento, existe circulación comunitaria
con variante Gamma (P.1 Manaos) y se detectaron recientemente Alfa (B.1.1.7, Reino Unido),
Beta (B.1.351 Sudáfrica) y Delta (B.1.617.2). Esta última, también ha sido detectada en zonas
fronterizas de Brasil y Argentina y tiene amplia distribución a nivel mundial.
Esta variante representa un riesgo particular, dado que se asociaría a una mayor capacidad de
infección sobretodo en personas no vacunadas, con esquemas incompletos o cuyos niveles de
anticuerpos se han visto reducidos. La capacidad de los anticuerpos para neutralizar a la variante
Delta se reduce entre 5 y 8 veces en comparación al virus original. Hasta la fecha los reportes
de salud pública en Canadá, Israel y Reino Unido han demostrado una reducción en la efectividad
de las vacunas de ARNm y vector viral frente a Delta (en especial en aquellas con esquemas
incompletos). Para CoronaVac los estudios preliminares marcan una reducción mayor a 30% de
la eficacia de la vacuna frente a la infección sintomática, con probabilidad de infección en
personas completamente vacunadas.
Existe evidencia, a través de modelos predictivos, estudios in vitro y reportes preliminares, de
infecciones en personas completamente vacunadas en zonas con circulación activa de variante
Delta.
2. Disminución de anticuerpos neutralizantes
Los anticuerpos disminuyen a lo largo del tiempo, y con esto los datos de eficacia inicial
reportados en los ensayos clínicos de la vacuna pueden variar. El mantener niveles detectables
de anticuerpos se ha asociado a una mayor capacidad para evitar la infección asintomática, la
enfermedad clínica y la mortalidad.
Estudios internacionales demuestran que en personas que cursaron la infección y aquellas que
fueron vacunadas, existe un descenso significativo de los anticuerpos a los 3 meses de
completado el esquema.
Esta reducción natural tendría un impacto en las vacunas según su eficacia inicial reportada, la
cual se vería reducida de un 95% a un 77% y ante una eficacia inicial del 70% se prevé que la
respuesta baje a un 33% de eficacia, a los 250 días. La disminución de la capacidad
neutralizante estaría asociada a la edad, comorbilidades, y el tiempo de vacunación.
Recientemente, el reporte del estudio de efectividad en Chile, a los 6 meses después de la 1era
dosis observó presencia de anticuerpos neutralizantes en un 75% de la población vacunada con 2
dosis con 28 días de intervalo entre ambas.
Los títulos promedio detectados a los 6 meses después de la primera dosis disminuyeron entre 3
a 4 veces respecto a los títulos promedio observados a las 4 semanas después de la segunda
dosis.
A nivel nacional existen estudios preliminares de población general inmunizada, en las que se
evidencia una disminución en los títulos de anticuerpos, sobre todo en aquellas inmunizadas en el
primer período de la campaña.
Con este antecedente, es más probable que sea necesario mantener niveles de anticuerpos más
altos frente a la circulación de VOCs.
3. Aplicación de esquema heterólogo como refuerzo
Se denomina esquema heterólogo a aquel en el cual se emplean vacunas de distintas
plataformas. Existe evidencia en cuanto a la eficacia de estos esquemas que combinan vacunas
de ARNm con vector viral, así como aquellas que combinan virus inactivado con ARNm (esto en
modelo murino), la aplicación del refuerzo con estas plataformas aumentaría los niveles de
anticuerpos neutralizantes y la respuesta específica de células T, con buen perfil de seguridad. Así
mismo, en el seguimiento de personas en quienes se aplicó un esquema heterólogo por
contraindicación médica (p.ej: alergia grave) no se notificaron efectos adversos. Esto también se
evidenció tras la decisión de personas quienes recibieron esquemas heterólogos en otro país.
La aplicación de esta tercera dosis con vacuna de ARNm (Pfizer) se dará a partir de los 90 días
de la 2da dosis en aquellos que recibieron un esquema inicial con vacuna de virus inactivado
(CoronaVac).
En suma
Si bien la declinación de los anticuerpos sucede con todas las vacunas aplicadas en Uruguay, los
títulos iniciales son mayores con Pfizer que con CoronaVac y la necesidad de refuerzo sería
entonces más precoz. De aquí la propuesta de tercer dosis a aquellos que recibieron esquema
primario con CoronaVac.
Bibliografía
1. Bernal J, Andrews N, Gower C, Gallagher E, Simmons R, Thelwall S et al.
Effectiveness of COVID-19 vaccines against the B.1.617.2 variant. 2021.
2. Boyarsky B, Werbel W, Avery R, Tobian A, Massie A, Segev D et al. Immunogenicity of
a Single Dose of SARS-CoV-2 Messenger RNA Vaccine in Solid Organ Transplant
Recipients. JAMA. 2021;325 (17):1784.
3. Chodick G, Tene L, Rotem R, Patalon T, Gazit S, Ben-Tov A et al. The Effectiveness of
the Two-Dose BNT162b2 Vaccine: Analysis of Real-World Data. Clinical Infectious
Diseases. 2021.
4. Favresse J, Bayart J, Mullier F, Elsen M, Eucher C, Van Eeckhoudt S et al. Antibody
titres decline 3-month post-vaccination with BNT162b2. Emerging Microbes & Infections.
2021;10(1):1495-1498.
5. Fisman D, Tuite A. Progressive Increase in Virulence of Novel SARS-CoV-2 Variants in
Ontario, Canada. 2021.
6. Kamar N, Abravanel F, Marion O, Couat C, Izopet J, Del Bello A. Three Doses of an
mRNA Covid-19 Vaccine in Solid-Organ Transplant Recipients. New England Journal of
Medicine. 2021.
7. Khoury D, Cromer D, Reynaldi A, Schlub T, Wheatley A, Juno J et al. Neutralizing
antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2
infection. Nature Medicine. 2021;27(7):1205-1211.
8. Lim W, Mak L, Leung G, Cowling B, Peiris M. Comparative immunogenicity of mRNA
and inactivated vaccines against COVID-19. The Lancet Microbe. 2021.
9. Mlcochova P, Kemp S, Dhar M, Papa G, Meng B, Mishra S et al. SARS-CoV-2
B.1.617.2 Delta variant emergence and vaccine breakthrough. 2021.
10. Ong S, Chiew C, Ang L, Mak T, Cui L, Toh M et al. Clinical and Virological Features of
SARS-CoV-2 Variants of Concern: A Retrospective Cohort Study Comparing B.1.1.7
(Alpha), B.1.315 (Beta), and B.1.617.2 (Delta). SSRN Electronic Journal. 2021.
11. Palgen J, Feraoun Y, Dzangué-Tchoupou G, Joly C, Martinon F, Le Grand R et al.
Optimize Prime/Boost Vaccine Strategies: Trained Immunity as a New Player in the Game.
Frontiers in Immunology. 2021;12.
12. Sheikh A, McMenamin J, Taylor B, Robertson C. SARS-CoV-2 Delta VOC in Scotland:
demographics, risk of hospital admission, and vaccine effectiveness. The Lancet.
2021;397(10293):2461-2462.
13. Tenforde M, Patel M, Ginde A, Douin D, Talbot H, Casey J et al. Effectiveness of
SARS-CoV-2 mRNA Vaccines for Preventing Covid-19 Hospitalizations in the United
States. 2021.
14. Wall E, Wu M, Harvey R, Kelly G, Warchal S, Sawyer C et al. Neutralising antibody
activity against SARS-CoV-2 VOCs B.1.617.2 and B.1.351 by BNT162b2 vaccination. The
Lancet. 2021;397(10292):2331-2333.
15. Public Health England,
https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_d
ata/file/1005517/Technical_Briefing_19.pdf
16. Zhang J, He Q, An C, et al. Boosting with heterologous vaccines effectively improves
protective immune responses of the inactivated SARS-CoV-2 vaccine Emerg Microbes
Infect. 2021; 1-28.